Wszystko, co pacjenci powinni wiedzieć o Aduhelm (aducanumab) | New Alzheimer's Medicine
Ostatnia aktualizacja: 15 marca 2022 r.

Możesz legalnie uzyskać dostęp do nowych leków, nawet jeśli nie zostały one zatwierdzone w Twoim kraju.
Dowiedz się jakArtykuł recenzowany przez dr Jana de Witt
7 czerwca 2021 roku, FDA zatwierdziła aducanumab (produkowany pod nazwą handlową "Aduhelm") do leczenia choroby Alzheimera, podnosząc nadzieje milionów pacjentów z chorobą Alzheimera i ich rodzin na całym świecie, podczas gdy eksperci wyrazili swoje obawy dotyczące tej decyzji.
Aduhelm jest pierwszym lekiem na chorobę Alzheimera, który został zatwierdzony przez FDA w ciągu 18 lat. Lek ten twierdzi, zgodnie z opublikowanymi wynikami, że jest w stanie spowolnić postęp samej choroby Alzheimera, a nie łagodzić jej objawy.
Decyzja FDA o zatwierdzeniu leku wzbudziła wiele kontrowersji. Niemniej jednak, Biogen, producent Aduhelm, spodziewa się rozpocząć wysyłkę Aduhelm do ponad 900 ośrodków opieki zdrowotnej w Stanach Zjednoczonych do końca czerwca 2021 roku.
StronaAduhelm jest obecnie dostępna dla odpowiednich pacjentów poza Stanami Zjednoczonymi na zasadzie compassionate use lub na zasadzie named patient basis. Dowiedz się więcej, przechodząc do sekcji "Dostęp do strony Aduhelm poza Stanami Zjednoczonymi".
Choroba Alzheimera: jeden z największych kryzysów społecznych, medycznych i gospodarczych XXI wieku
Choroba Alzheimera jest zwyrodnieniowym zaburzeniem mózgu, które obecnie dotyka ponad 40 milionów ludzi na całym świecie i jest najczęstszą przyczyną demencji. Przez wiele lat uważana za normalny element procesu starzenia się, choroba Alzheimera jest obecnie uznawana za schorzenie o poważnych skutkach zdrowotnych, gospodarczych i społecznych.
Naukowcy nie rozumieją jeszcze w pełni, co powoduje chorobę Alzheimera, ale uważa się, że jest ona spowodowana kombinacją czynników, takich jak:
- Starzenie się: Choroba Alzheimera jest najczęściej diagnozowana po 65 roku życia (choroba Alzheimera o późnym początku). Około jedna trzecia osób w wieku 85 lat i starszych cierpi na chorobę Alzheimera. Zmiany w mózgu związane ze starzeniem się mogą przyczynić się do rozwoju choroby.
- Historia rodzinna: Posiadanie członka rodziny pierwszego stopnia z chorobą Alzheimera zwiększa ryzyko rozwoju tej choroby u danej osoby. Naukowcy uważają, że predyspozycje genetyczne mogą powodować wczesną postać choroby Alzheimera, która występuje u osób w wieku od 30 do 60 lat. Tylko 10% pacjentów z chorobą Alzheimera cierpi na wczesną postać tej choroby.
- Inne czynniki: Naukowcy znaleźli powiązania między pogorszeniem funkcji poznawczych a chorobami serca, a także cukrzycą i otyłością. Najsilniejsze dowody łączą zdrowie mózgu ze zdrowiem serca. Urazy głowy zostały również powiązane ze zwiększonym ryzykiem wystąpienia choroby Alzheimera, ponieważ mogą one powodować tworzenie się blaszek amyloidowych. Osoby z zespołem Downa, w którym dodatkowy chromosom dyktuje kod genetyczny dla rodzaju białka amyloidowego związanego z chorobą Alzheimera, są również narażone na zwiększone ryzyko.
Większość osób z chorobą Alzheimera jest diagnozowana w stadium łagodnym, kiedy objawy stają się bardziej wyraźne, a choroba spowodowała już pewne uszkodzenia mózgu, pomimo faktu, że niektóre objawy zaczynają się pojawiać nawet dekadę przed diagnozą. Wczesne objawy mogą być lekceważone przez pacjentów (często z powodu wstydu) lub po prostu niezauważane przez lekarzy lub członków rodziny. Średnia długość życia pacjentów wynosi od 3 do 11 lat od momentu postawienia diagnozy.
"Z czasem mama zapomniała, kim byłem"
Choroba Alzheimera ma trzy różne stadia:
- Łagodna: W pierwszych stadiach pacjenci doświadczają utraty pamięci, takiej jak zapominanie o ważnych datach i wydarzeniach, częste powtarzanie pytań, dłuższe wykonywanie codziennych zadań, ciągłe problemy z finansami, częste gubienie przedmiotów i niepokój. (Aby dowiedzieć się więcej o tym, jak duża utrata pamięci jest normalnym objawem starzenia się, zobacz infografikę przygotowaną przez National Institutes of Health (NIH)'s National Institute on Aging).
- Umiarkowany: W miarę postępu choroby pacjenci mają zwiększoną utratę pamięci i dezorientację, trudności z komunikacją i czytaniem, trudności z rutynowymi czynnościami, takimi jak ubieranie się, problemy z rozpoznawaniem rodziny i przyjaciół, paranoję, halucynacje i błądzenie.
- Ciężka: Pacjenci z ciężką postacią choroby Alzheimera doświadczają niezdolności do komunikowania się, utraty wagi, trudności w połykaniu oraz utraty kontroli nad jelitami i pęcherzem. Na tym etapie pacjenci przebywają w łóżku przez większość czasu i są całkowicie zależni od innych osób w zakresie ich opieki.
Trudności pacjentów cierpiących na chorobę Alzheimera są ogromne, ponieważ choroba ta wpływa na każdy aspekt ich codziennego życia. Poniżej można przeczytać kilka historii autorstwa pacjentów lub przyjaciół i rodzin pacjentów.
Sandy, były dentysta i asystent profesora na Harvardzie, rozmawiał z reporterami CNN o tym, jak zdał sobie sprawę, że jego zapominalstwo przerodziło się w coś gorszego: "'Patrzę na akta sprawy dentystycznej przez półtorej godziny', wspomina. 'Czytam je, są w moim mózgu. Potem zamykam akta i nie pamiętam dosłownie nic z tego przypadku."" Niedługo potem zdiagnozowano u niego chorobę Alzheimera.
Fred Walker, u którego żony zdiagnozowano chorobę Alzheimera, rozmawiał z Alzheimer's Research UK o swojej żonie: "'Korzystanie z telefonu stało się poza jej możliwościami. Nie była w stanie opanować wszystkich przycisków. Kuchenka była zbyt skomplikowana, aby ją zrozumieć i zawsze istniało niebezpieczeństwo, że zostawi włączony gaz. Zrobienie filiżanki herbaty było dla niej zbyt dużym wyzwaniem i myliła się co do ilości herbaty, mleka i wody."
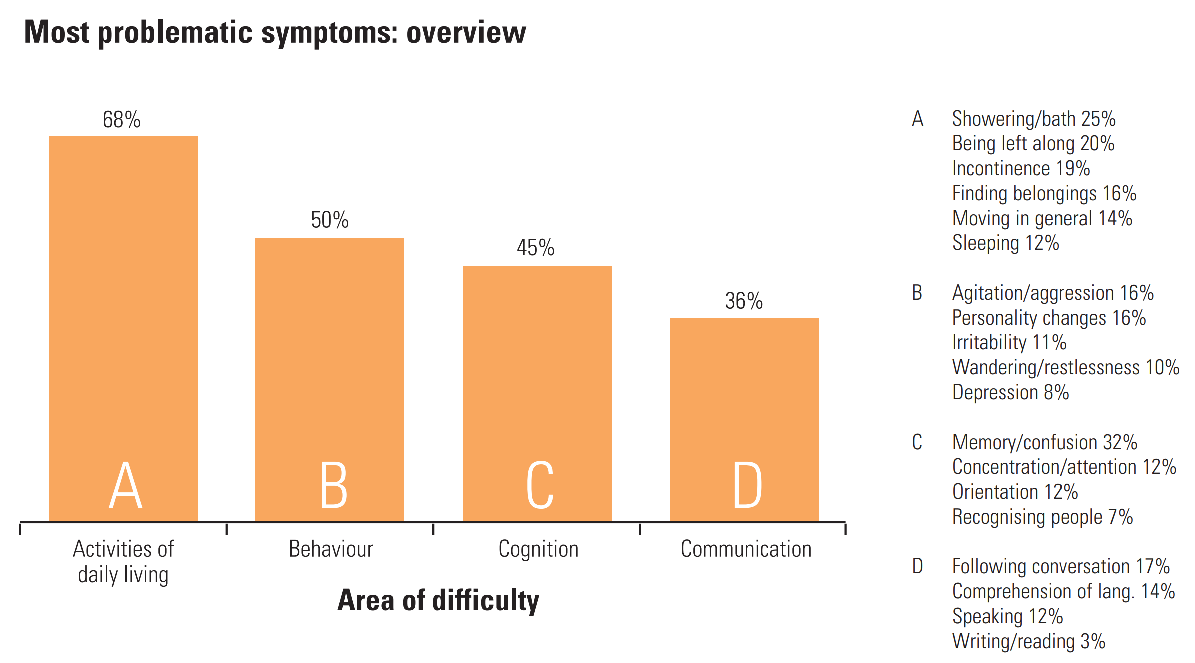
Choroba Alzheimera, kiedy osiąga późniejsze stadia i przechodzi w demencję, jest opisywana przez Laury dla Alzheimer's Society:
"[...] wyruszyliśmy w nową podróż. Z 24-godzinną opieką, codziennym podawaniem leków i całkowitym pogubieniem się mamy we mgle własnego umysłu. [...] Dopiero wtedy dotarło do nas, jak straszny jest widok ukochanej osoby cierpiącej na tę okrutną, podstępną chorobę. [...] Zaczęła mieć halucynacje".
everyone.org Założyciel Sjaak Vink potwierdza i rozpoznaje każdy z tych opisów. U jego matki zdiagnozowano chorobę Alzheimera w 2015 roku.
To trudna droga dla pacjentów i ich bliskich - a choroba nie ogranicza się tylko do wpływu na ich życie osobiste i życie ich bliskich.
Presja na opiekunów, budżety i decydentów politycznych
Pacjenci z chorobą Alzheimera wymagają coraz bardziej wymagającej opieki w miarę pogarszania się ich stanu, takiej jak opieka w domu, opieka nocna, usługi domowe lub opieka pielęgniarska; w końcu pacjenci mogą być zmuszeni do zamieszkania w ośrodkach opieki lub domach opieki. Choroba bardzo obciąża pacjenta, członków jego rodziny (którzy często poświęcają się opiece nad chorym), a także budżet osobisty i budżet państwa.
Opiekunowie rodzinni stają w obliczu trudnego zadania, jakim jest opieka nad ich bliskimi cierpiącymi na chorobę Alzheimera. Badanie wykazało, że 95 % opiekunów rodzinnych w Zjednoczonym Królestwie twierdzi, że ma to wpływ na ich zdrowie fizyczne lub psychiczne, 69 % zgłosiło uczucie ciągłego wyczerpania, 64 % odczuwało niepokój, a 49 % depresję.
W Europie choroba Alzheimera i inne formy demencji dotykają około 10 mln osób, a oczekuje się, że do 2030 r. liczba ta wzrośnie do 14 mln. Szacuje się, że koszty ekonomiczne demencji w Europie wzrosną do ponad 250 mld EUR do 2030 r., z czego ponad 50 % będą stanowić koszty opieki nieformalnej. Dostęp do opieki i leczenia jest nierówny, a w szczególności w Europie Wschodniej brakuje dostępnych systemów wsparcia i programów socjalnych dla pacjentów z chorobą Alzheimera i ich opiekunów.
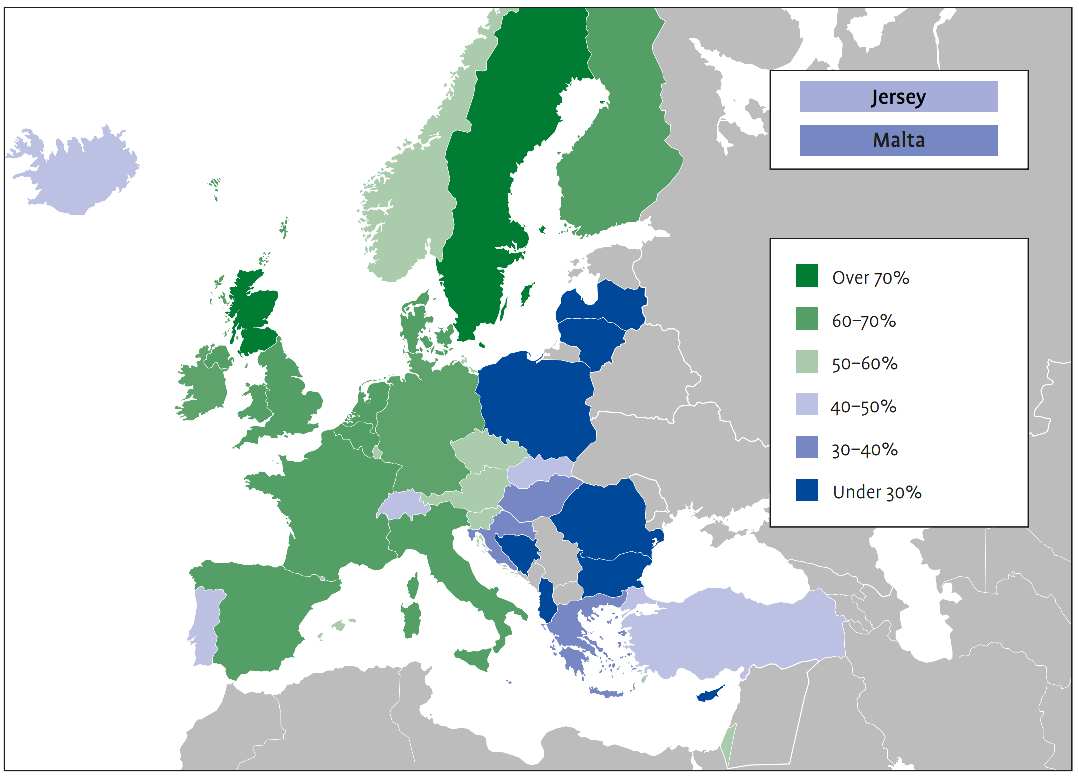
W Stanach Zjednoczonych choroba Alzheimera weszła niedawno na listę 10 najważniejszych przyczyn zgonów i jest jedyną w tej dziesiątce, na którą nie ma znanego lekarstwa. Choroba ta dotyka 6 milionów ludzi w USA, a przewiduje się, że do 2050 roku liczba ta wzrośnie do 12 milionów. Do końca 2021 r. całkowity krajowy koszt opieki nad osobami cierpiącymi na chorobę Alzheimera i inne demencje może wynieść 355 miliardów dolarów i przewiduje się, że do 2050 r. osiągnie 1,1 biliona dolarów.
Środki te, jakkolwiek astronomiczne, są niezbędne, aby zapewnić pacjentom odpowiednie wsparcie i, na ile to możliwe, godne życie.
Ze względu na konieczność zapewnienia całodobowej opieki, zwłaszcza w późniejszych stadiach choroby, pacjenci z chorobą Alzheimera są szczególnie poszkodowani, gdy opieka nad nimi jest nieodpowiednia, co ma miejsce w wielu krajach lub społecznościach. W samym tylko Zjednoczonym Królestwie dziesiątki tysięcy osób cierpiących na demencję trafia co roku na oddziały ratunkowe z powodu infekcji, upadków i odwodnienia, które są wynikiem niewystarczającej opieki. To dodatkowo obciąża krajowe budżety na opiekę zdrowotną.
W czasie pandemii COVID-19 pacjenci z chorobą Alzheimera zostali poważnie dotknięci i ponieśli wysoką śmiertelność z powodu wieku, innych długotrwałych chorób oraz samych wyzwań związanych z chorobą Alzheimera (np. problemy z pamięcią i dezorientacja, które sprawiają, że pacjenci mają trudności z przestrzeganiem wytycznych zapobiegających zakażeniom COVID-19).
Pacjenci z chorobą Alzheimera przebywający w domach opieki odczuli szkodliwe skutki tej choroby również w inny sposób. Ze względu na niewystarczającą opiekę i wymuszoną separację od bliskich w celu zapewnienia im bezpieczeństwa przed COVID-19 wynikająca z tego samotność i izolacja jeszcze bardziej pogorszyły ich zdrowie psychiczne i fizyczne.
Potrzebne są skuteczne metody leczenia tej choroby, aby zapobiec osiągnięciu poważnych rozmiarów przez kryzys zdrowotny i gospodarczy.
Najważniejsze osiągnięcia w badaniach nad chorobą Alzheimera
W 1910 r. niemiecki lekarz Emil Kraepelin nadał chorobie Alzheimera nazwę "choroba Alzheimera " na cześć lekarza Aloisa Alzheimera, który odkrył patologiczne cechy demencji przedchorobowej u pacjenta z głęboką utratą pamięci i pogarszającymi się zmianami psychologicznymi. Badania nad metodami leczenia choroby Alzheimera rozpoczęto w Stanach Zjednoczonych dopiero pod koniec lat 80. ubiegłego wieku, ale spotkały się one z krytyką, ponieważ lekarze nadal uważali, że choroba Alzheimera jest nieuniknioną konsekwencją starzenia się.
W Stanach Zjednoczonych w 1978 r. National Institute on Aging (NIA) i Alzheimer's Association nawiązały współpracę z firmą Pfizer i rozpoczęły pierwsze badania kliniczne nad lekiem, który miał leczyć objawy choroby Alzheimera. Lek został zatwierdzony w 1993 roku: Cognex (takryna), zgodnie z opublikowanymi wynikami, poprawił zdolności poznawcze u niektórych pacjentów, ale nie powstrzymał pogłębiania się choroby.
W ciągu następnej dekady zatwierdzono sześć kolejnych leków, wszystkie przeznaczone do leczenia objawów poznawczych choroby Alzheimera:
- Aricept (donepezil): w leczeniu objawów związanych z pamięcią i myśleniem
- Razadyne (galantamina): w leczeniu objawów związanych z pamięcią i myśleniem
- Exelon (rywastygmina): w leczeniu objawów związanych z pamięcią i myśleniem
- Namenda (memantyna): w celu poprawy pamięci, uwagi, rozumu, języka
- Namzaric (memantyna + donepezil): połączenie powyższych.
- Belsomra (Suvorexant): w leczeniu bezsenności u pacjentów z chorobą Alzheimera
Ostatni lek, który został zatwierdzony do leczenia choroby Alzheimera, został zatwierdzony w 2003 roku. Przez dziesiątki lat choroba Alzheimera była uważana za naturalną konsekwencję starzenia się. Niewiele środków przeznaczano na znalezienie metody leczenia, ponieważ toczyła się dyskusja, czy jest to rzeczywista choroba. W ciągu ostatnich 20 lat naukowcy poświęcili jednak wiele zasobów na badanie tej choroby i opracowanie metody jej leczenia.
Brak leków na chorobę Alzheimera nie wynika z zaniedbań ze strony firm farmaceutycznych - branża ta zainwestowała miliardy w badania. Sama firma Eli Lilly wydała 4,2 miliarda dolarów w ciągu trzech dekad próbując opracować skuteczny lek, a Narodowe Instytuty Zdrowia Stanów Zjednoczonych (NIH) wydają ponad 500 milionów dolarów rocznie na badania i rozwój terapii.
Od 2013 r. Kongres Stanów Zjednoczonych potroił roczny budżet NIH na finansowanie badań nad chorobą Alzheimera i pokrewnymi demencjami, osiągając 3,1 mld dolarów w 2019 r.
Krajowe i prywatne fundusze zaowocowały 2173 badaniami klinicznymi, które zostały przeprowadzone do 2019 roku w celu przetestowania różnych teorii. Najważniejsze testowane teorie:
- 19% badań koncentrowało się na hipotezie neuroprzekaźnika.
- 17,0% badań testowało hipotezę kaskady mitochondrialnej i inne pokrewne hipotezy.
- 12,7% testowało hipotezę propagacji tau
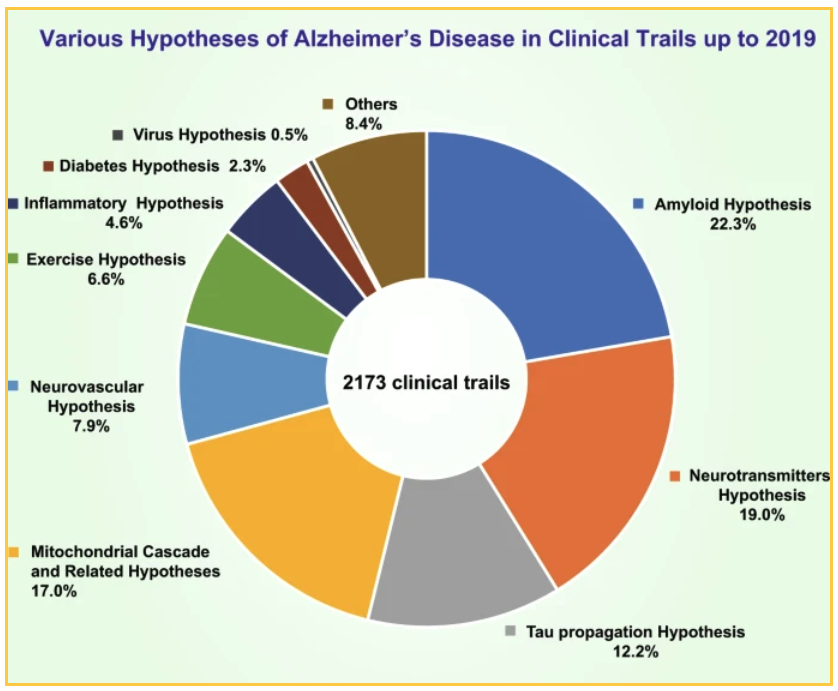
W 22,3% badań, których celem jest amyloid, skupiono się na różnych sposobach redukcji blaszki miażdżycowej:
- Przeciwciała wytwarzane przez układ odpornościowy przeciwko beta-amyloidowi: "Aktywne szczepionki", które po wstrzyknięciu do organizmu wyzwalają układ odpornościowy do produkcji przeciwciał niszczących beta-amyloid i zmniejszających poziom beta-amyloidu w mózgu.
- Laboratoryjnie wytworzone przeciwciała przeciwko beta-amyloidowi: "Szczepionki pasywne", które są uważane za bardziej skuteczne i bezpieczniejsze niż próby wywołania produkcji przeciwciał w organizmie.
- Zmniejszanie produkcji beta-amyloidu: Niektóre eksperymentalne metody leczenia zmieniają zachowanie pewnych białek, które mogą zapobiegać lub zmniejszać produkcję beta-amyloidu.
- Zapobieganie agregacji beta-amyloidu: Naukowcy prowadzą badania nad lekami, które zapobiegają początkowym interakcjom między beta-amyloidem a komórkami mózgu, które prowadzą do śmierci komórki mózgowej.
- Zwiększenie usuwania beta-amyloidu: Techniki takie jak mobilizowanie układu odpornościowego do atakowania beta-amyloidu lub podawanie naturalnych środków o działaniu anty-amyloidowym.
- Naturalne środki o działaniu anty-amyloidowym: Dożylna immunoglobulina (IVIg) otrzymywana od dawców krwi ludzkiej zawiera naturalne przeciwciała, które mogą zmniejszać poziom beta-amyloidu.
Co to jest Aduhelm (aducanumab-avwa)?
Aduhelm (aducanumab) jest przeciwciałem anty-amyloidowym stosowanym w leczeniu choroby Alzheimera. Jest ono przeznaczone do usuwania blaszek beta-amyloidu, które tworzą się między komórkami mózgowymi w nieprawidłowych ilościach u pacjentów z chorobą Alzheimera, co prowadzi do śmierci dotkniętych komórek mózgowych. Beta-amyloid został zidentyfikowany w 1984 r. i szybko uznano go za główny czynnik wywołujący uszkodzenie komórek mózgowych, natomiast w 1986 r. zidentyfikowano białko tau, będące kluczowym składnikiem splątań i drugim czynnikiem wywołującym uszkodzenie komórek mózgowych.
Aduhelm został opracowany przez Biogen, Inc, międzynarodową firmę biotechnologiczną z siedzibą w Massachusetts, Stany Zjednoczone. Aduhelm jest podawany w comiesięcznych wstrzyknięciach.
Aduhelm ma długą historię.
Szwajcarska firma biotechnologiczna Neurimmune Therapeutics AG, we współpracy z Uniwersytetem w Zurychu, zidentyfikowała ochronne przeciwciała anty-amyloidowe u zdrowych osób starszych i pacjentów z powoli postępującą demencją i doprowadziła do odkrycia aducanumabu, aktywnego składnika w Aduhelm. U pacjentów z łagodną chorobą Alzheimera roczny okres comiesięcznych dożylnych wlewów aducanumabu zmniejsza blaszki amyloidowe, co skutkuje spowolnieniem spadku zdolności poznawczych.
W 2007 r. firma Neurimmune udzieliła firmie Biogen licencji na aducanumab do leczenia choroby Alzheimera i współpracuje z Biogen nad jego rozwojem.
Jak działa Aduhelm ?
Choroba Alzheimera wydaje się być wynikiem niezwykłego nagromadzenia w mózgu dwóch białek: beta-amyloidu i tau. Beta-amyloid jest białkiem normalnie występującym w mózgu, które w chorobie Alzheimera zlepia się w blaszki amyloidowe pomiędzy komórkami mózgowymi - teoria amyloidowa mówi, że blaszki te uszkadzają i ostatecznie zabijają komórki mózgowe. Blaszki amyloidowe wydają się rozwijać wcześniej, podczas gdy splątki tau pojawiają się w późniejszym stadium choroby. Duża część badań prowadzonych w celu znalezienia metody leczenia choroby Alzheimera koncentruje się na usuwaniu blaszek amyloidowych.
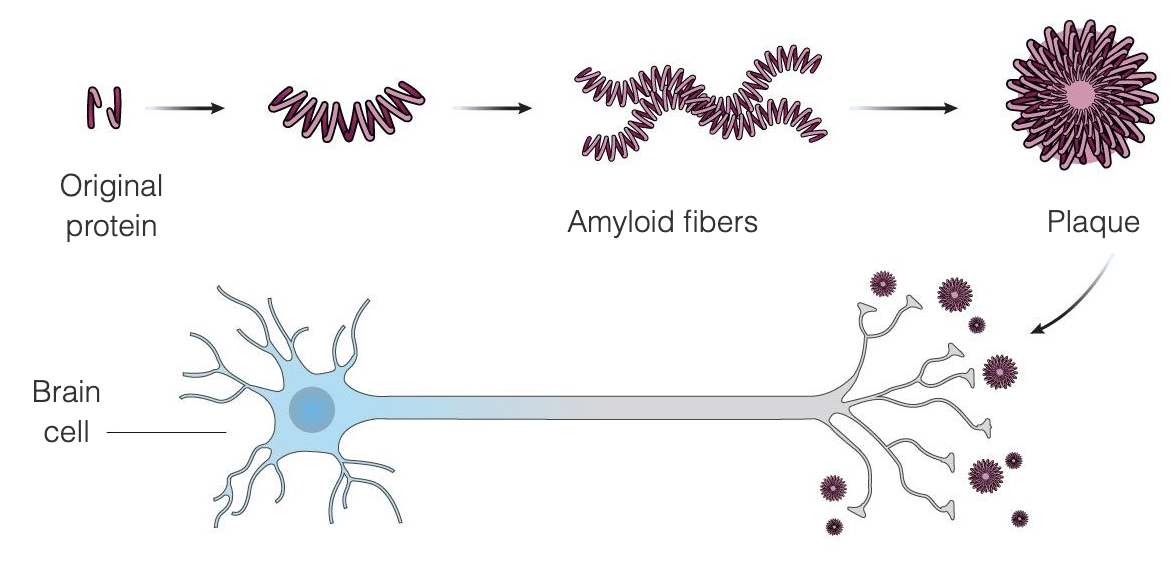
Aduhelm został zaprojektowany do leczenia choroby Alzheimera na bardzo wczesnych etapach choroby poprzez wiązanie się z blaszkami amyloidowymi, co powoduje, że układ odpornościowy niszczy blaszki, postrzegając je jako obcego najeźdźcę. Zgodnie z założeniem, po usunięciu blaszek, komórki mózgowe przestaną umierać, a funkcje poznawcze przestaną się pogarszać. Aduhelm wykorzystuje ten mechanizm w celu spowolnienia postępu choroby, adresując go szczególnie do pacjentów we wczesnych stad iach choroby Alzheimera. Aduhelm nie odwraca już powstałych uszkodzeń.
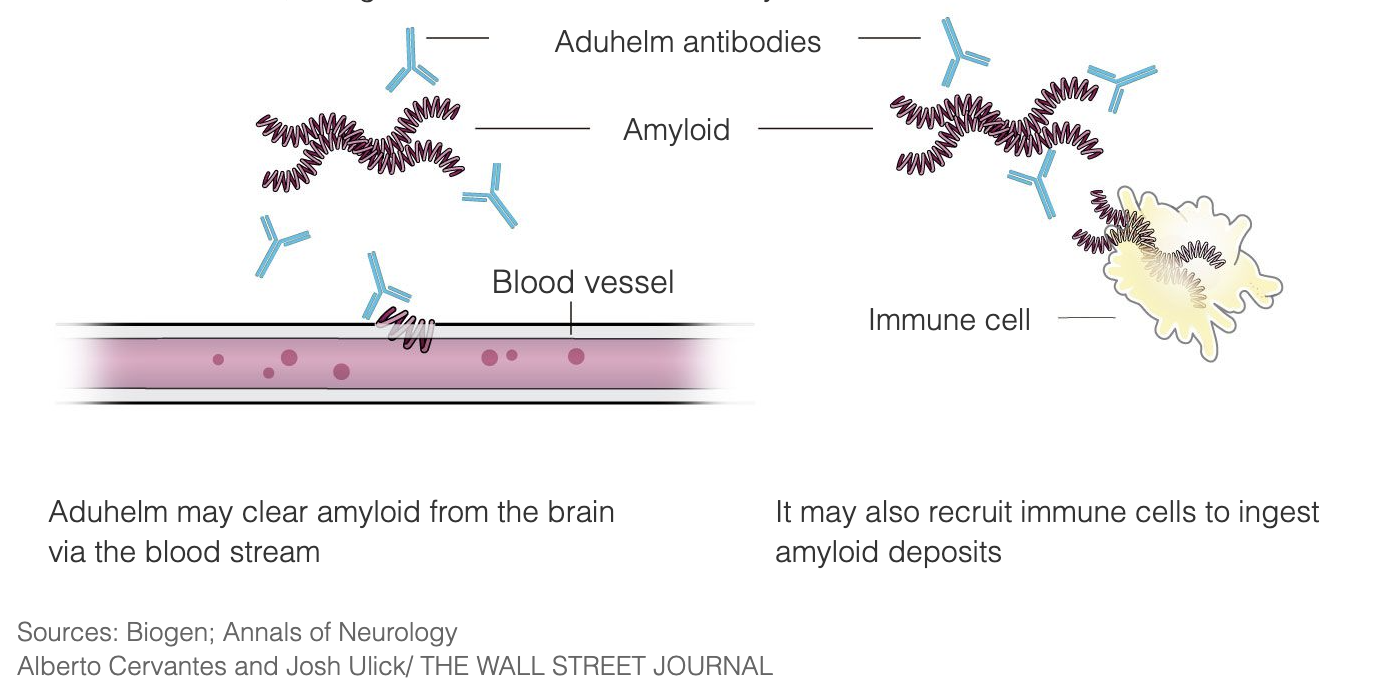
Blaszki amyloidowe są celem badań nad chorobą Alzheimera i rozwoju medycyny od 3 dekad, a Aduhelm jest jednym z takich sposobów leczenia, nad którymi pracowano przez lata.
"Kościół Świętej Amyloidy"
Naukowcy nie są jeszcze zgodni co do tego, co powoduje chorobę Alzeimera, ale mają pewne teorie. Jedna z nich nazywa się "hipotezą amyloidową" i Aduhelm został opracowany przy założeniu, że ta teoria jest poprawna.
Hipoteza amyloidowa głosi, że blaszki amyloidowe tworzące się między komórkami mózgu powodują ich obumieranie, co prowadzi do pogorszenia zdolności poznawczych. Jest to długoletnia teoria, która nigdy nie została powszechnie zaakceptowana - a niepowodzenie dotychczasowych badań klinicznych, których celem były blaszki amyloidowe, ośmieliło jej krytyków. Niektórzy nazywają grupę zwolenników tej teorii "Kościołem Świętego Amyloidu" ze względu na ich niechęć graniczącą z odmową przyjęcia alternatywnych teorii.
Nawet normalna funkcja beta-amyloidu w mózgu jest kwestionowana przez naukowców, ponieważ nie są oni zgodni co do tego, jaką rolę odgrywa on naturalnie w organizmie człowieka, czy też jest wyłącznie markerem choroby Alzeimera.
Częstym kontrargumentem wobec hipotezy amyloidowej jest fakt, że blaszki amyloidowe znajdują się w mózgach wielu starszych osób o normalnych zdolnościach poznawczych. Co ciekawe, niektóre pośmiertne badania osób powyżej 90 roku życia z niezwykłą pamięcią ujawniły w ich mózgach blaszki amyloidowe w różnym stopniu - niektóre z nich miały tak dużą gęstość, że przypominały najcięższe przypadki Alzheimera, a także miały o wiele więcej neuronów niż osoby zmarłe na Alzheimera.
Niektórzy badacze uważają, że beta-amyloid może w rzeczywistości pełnić rolę ochronną.
George Perry, neurobiolog z University of Texas at San Antonio, sugeruje, że "akumulacja beta-amyloidu i tau jest w rzeczywistości reakcją ochronną na związane z wiekiem napięcia metaboliczne w komórce" i jest szczególnie pomocna w redukcji stresu oksydacyjnego w mózgu (stres oksydacyjny wzrasta z wiekiem, co uszkadza komórki).
W kilku badaniach analizowano inne potencjalne przyczyny choroby Alzheimera. Jedno z takich badań zostało przeprowadzone przez naukowców z Icahn School of Medicine at Mount Sinai w Nowym Jorku, którzy odkryli, że dwa szczepy wirusa zwanego HHV (należącego do rodziny herpeswirusów) występują w większych ilościach w mózgach osób z chorobą Alzheimera. Chociaż nie jest pewne, czy te dwa wirusy powodują chorobę (bardziej prawdopodobne jest, że przyczyną jest połączenie wirusa i pewnego wariantu genu zwanego APOE), dane sugerują, że infekcja zwiększa ryzyko rozwoju Alzheimera, a osoby leczone lekami przeciwwirusowymi są dziesięciokrotnie mniej narażone na rozwój Alzheimera.
Na poparcie teorii amyloidowej przemawiają jednak wyniki badań genetycznych, które łączą problemy z genami związanymi z amyloidem z rozwojem choroby Alzheimera o wczesnym początku (u osób w wieku od 30 do 65 lat). Zespół Downa jest uważany za czynnik ryzyka, ponieważ naukowcy odkryli, że osoby z zespołem Downa mają dodatkową kopię chromosomu, który zawiera gen kodujący białko amyloidowe związane z wczesnym stadium choroby Alzheimera.
Inne nieprawidłowości genetyczne mogą prowadzić do produkcji dłuższych wariantów beta-amyloidu, które łatwiej tworzą blaszki miażdżycowe, lub zwiększać produkcję beta-amyloidu i powodować nieco rzadsze przypadki wczesnego wystąpienia choroby Alzheimera. Wielu członków jednej rodziny może być nosicielami tych mutacji genowych i zwiększać indywidualne ryzyko rozwoju wczesnego stadium choroby Alzheimera.
Zwolennicy teorii amyloidowej sugerują, że wcześniejsze badania z udziałem leków ukierunkowanych na blaszki amyloidowe były po prostu błędne. Na przykład, badanie semagacestatu, inhibitora produkcji białek beta-amyloidu, pogorszyło zdolności poznawcze uczestników badania; naukowcy zaobserwowali również wzrost zachorowań na raka skóry wśród uczestników. Może to wynikać z faktu, że semagacestat hamował produkcję również innych białek, nie tylko beta-amyloidu, z których niektóre pełnią ważne funkcje w organizmie człowieka.
Najbardziej popieranym wyjaśnieniem niepowodzenia tych badań, które są ukierunkowane na amyloidy, jest to, że leki te są właściwe, ale podawane w niewłaściwym momencie rozwoju choroby Alzheimera - są one podawane zbyt późno w procesie tworzenia się blaszek amyloidowych, który to proces rozpoczyna się dziesiątki lat przed wystąpieniem objawów.
Michael Murphy, neurobiolog z University of Kentucky, zauważa, że ""prawdopodobnie mamy już lek, który mógłby leczyć chorobę Alzheimera, gdybyśmy podawali go ludziom w wieku 50 lat"".
Toczy się poważna debata na temat przyczyn choroby Alzheimera, a eksperci nie są jeszcze zgodni - ale pacjenci i naukowcy złapali nowy wiatr w żagle dzięki wynikom aducanumabu w jednym z badań klinicznych 3 fazy Aduhelm.
Aduhelm w badaniach klinicznych
Badania kliniczne odbywają się w czterech fazach:
- Faza 0: Lek jest testowany w bardzo małych ilościach na mniej niż 15 uczestnikach, aby upewnić się, że nie jest szkodliwy i że badanie może być kontynuowane.
- Faza 1: Lek jest testowany na 20 do 80 uczestnikach bez podstawowych schorzeń, aby upewnić się, że nie ma poważnych skutków ubocznych. Według FDA, około 70% leków przechodzi do fazy 2.
- Faza 2: Lek jest testowany na kilkuset uczestnikach cierpiących na schorzenie, na które lek jest przeznaczony, przez okres kilku miesięcy lub lat, w celu zebrania informacji o jego skuteczności i skutkach ubocznych. Około 33% leków przechodzi do Fazy 3.
- Faza 3: Lek jest testowany na maksymalnie 3000 uczestników cierpiących na schorzenie, na które lek jest przeznaczony i może trwać kilka lat. Lek musi mieć udowodnione bezpieczeństwo i skuteczność. 25-30% leków przechodzi do Fazy 4.
- Faza4: Tafaza obejmuje tysiące uczestników przez wiele lat i odbywa się po zatwierdzeniu leku przez FDA. Jej celem jest zebranie większej ilości informacji na temat jego długoterminowego bezpieczeństwa i skuteczności.
Aduhelm w fazie 1
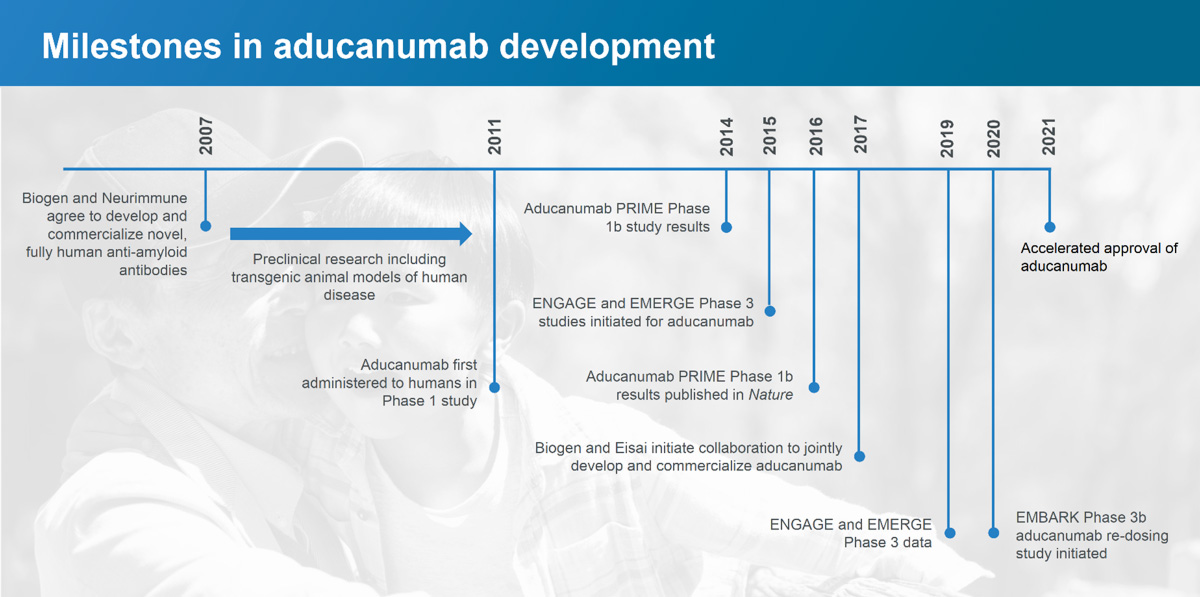
Firma Biogen przeprowadziła kilka badań klinicznych nad aducanumabem, począwszy od trzech badań fazy 1 w 2011 roku, w których testowano aducanumab u zdrowych ochotników i pacjentów z chorobą Alzheimera w USA i Japonii, stosując różne dawki aducanumabu i placebo. Niektórzy pacjenci byli włączeni do badania przez ponad 3 lata.
W 2016 roku firma Biogen opublikowała wyniki swojego badania klinicznego 1 fazy, w którym badacze podawali uczestnikom badania z łagodną chorobą Alzheimera comiesięczne dożylne wlewy aducanumabu przez rok. U uczestników, którym podawano aducanumab, stwierdzono obniżony poziom beta-amyloidu w mózgu oraz spowolnienie spadku zdolności poznawczych mierzonych na podstawie oficjalnej klinicznej oceny demencji. Wśród uczestników, którzy otrzymywali wlewy aducanumabu, badacze firmy Biogen odnotowali również zmniejszenie efektów ubocznych, takich jak ARIA (nieprawidłowości w obrazowaniu związane z amyloidem, np. obrzęk mózgu lub krwawienie w mózgu). Firma Biogen uznała te wyniki za wystarczająco zachęcające, aby przejść do fazy 2.
Aduhelm w fazie 2
Biogen rozpoczął badania fazy 2 pod koniec 2018 roku i oceniał bezpieczeństwo kontynuowania dawkowania aducanumabu, oprócz sprawdzania redukcji blaszek amyloidowych i spowolnienia spadku poznawczego u uczestników z wczesnym stadium i objawową chorobą Alzheimera.
Aducanumab nie spełnił swojego podstawowego celu, jakim było wykazanie wolniejszego spadku zdolności poznawczych w 12-miesięcznym okresie, ale po ponownej analizie 18-miesięcznych danych z badania zaobserwowano pozytywne efekty w jednej z pięciu dawek - najwyższej dawce aducanumabu. Wykazano, że najwyższa dawka zmniejszyła liczbę blaszek amyloidowych w mózgu, jak również wykazała pozytywne odpowiedzi na procesy poznawcze.
Działania niepożądane, takie jak ARIA (amyloid-related imaging abnormalities) obserwowano, podobnie jak w fazie 1, u około 10% wszystkich uczestników i u mniej niż 15% uczestników, którzy otrzymali najwyższe dawki aducanumabu.
"18-miesięczne wyniki badania BAN2401 są imponujące i dostarczają ważnego wsparcia dla hipotezy amyloidu, powiedział Jeff Cummings, dyrektor założyciel, Cleveland Clinic Lou Ruvo Center for Brain Health, w oświadczeniu dla Biospace.
Aduhelm w fazie 3
Po uzyskaniu wyników badania fazy 2, firma Biogen przeprowadziła dwa badania fazy 3, nazwane Engage i Emerge, do których zakwalifikowano nieco poniżej 3300 uczestników ze stosunkowo łagodną chorobą Alzheimera w Ameryce Północnej, Australii, Europie i Azji. Aducanumab podawano raz w miesiącu w niskich i wysokich dawkach poprzez wstrzyknięcie do krwiobiegu i porównywano z wynikami uczestników, którzy otrzymywali placebo.
W marcu 2019 r. firma Biogen wstrzymała dwa badania fazy 3, powołując się na analizę bezcelowości przeprowadzoną przez niezależny komitet monitorujący dane, który stwierdził, że aducanumab nie wydaje się działać zgodnie z założeniami.
Decyzja ta dotyczyła 3300 uczestników badania. Protokoły uczestnictwa w badaniu obejmowały częste i dłuższe wizyty, w tym pobieranie krwi, rezonans magnetyczny, skanowanie PET, a czasami nakłuwanie kręgosłupa. Siedem miesięcy po zaprzestaniu dwóch badań firma Biogen ogłosiła, że ponowna analiza dodatkowych danych wykazała, że przy wysokich dawkach lek wydaje się zmniejszać spadek zdolności poznawczych.
Biogen napisał w komunikacie prasowym, że dodatkowe dane składają się z wyników z podzbioru pacjentów w badaniu Engage fazy 3, którzy otrzymali wysoką dawkę aducanumabu i doświadczyli znacznego zmniejszenia zaburzeń poznawczych i funkcjonalnych (pamięć, orientacja, język), a także korzyści w zakresie czynności w życiu codziennym (wykonywanie prac domowych, zakupy, samodzielne wychodzenie z domu). Na podstawie tych wyników firma Biogen złożyła wniosek o zatwierdzenie regulacyjne dla aducanumabu w październiku 2019 r. i otrzymała je na początku czerwca 2021 r.
Chociaż badania kliniczne fazy 3 nie były w pełni rozstrzygające w kwestii korzyści terapii w zakresie funkcji poznawczych i funkcjonowania, FDA stwierdziła, że badania wykazały, iż aducanumab, produkowany pod nazwą handlową Aduhelm, może redukować blaszki amyloidowe, co stanowiło podstawę do podjęcia przez FDA decyzji o przyspieszonej akceptacji.
Uczestnik badania i reporter Phil Gutis napisał na platformie informacyjnej Being Patient: "Dzięki skanowaniu PET przeprowadzonemu w ramach badania podłużnego dowiedziałem się, że w moim mózgu nie ma już amyloidu. Skan, wykonany około dwa lata temu jako część badania Aging Brain Cohort w Penn Memory Center, potwierdził moje rosnące przeczucia, że aducanumab rzeczywiście mi pomaga. Zacząłem się czuć, jakbym wychodził z ciągłej mgły umysłowej... Negatywnym aspektem jest to, że wspomnienia, które straciłem, nie powróciły."
Działania niepożądane i przeciwwskazania do stosowania Aduhelm
Według Biogen's Medication Guide, przed rozważeniem Aduhelm, pacjenci powinni poinformować swoich dostawców usług medycznych o wszystkich swoich warunkach medycznych, w tym, czy są one:
- są w ciąży lub planują zajść w ciążę
- karmią piersią lub zamierzają karmić piersią
Pacjenci powinni poinformować swoich pracowników służby zdrowia o wszystkich przyjmowanych lekach, zarówno tych wydawanych na receptę, jak i tych, które wydawane są bez recepty, witaminach i suplementach ziołowych.
Zgodnie z przewodnikiem po lekach firmy Biogen, głównym znanym działaniem niepożądanym leku Aduhelm jest ARIA (amyloid-related imaging abnormalities), takie jak obrzęk mózgu i krwawienie w mózgu. Inne działania niepożądane to:
- poważne reakcje alergiczne, takie jak obrzęk twarzy, warg, jamy ustnej lub języka oraz pokrzywka
- bóle głowy
- biegunka
- dezorientacja/delirium/zmieniony stan psychiczny/dezorientacja
- upadki
ARIA jest częstym działaniem niepożądanym, które zazwyczaj nie powoduje żadnych objawów, ale może być poważne. Najczęściej obserwuje się go jako tymczasowy obrzęk mózgu, który zwykle ustępuje samoistnie w miarę upływu czasu. Jednocześnie usuwanie amyloidu z mózgu powoduje również usunięcie amyloidu z naczyń krwionośnych, co może powodować powstawanie małych plamek krwawienia w mózgu lub na jego powierzchni.
ARIA zaobserwowano u 41% uczestników badań klinicznych, którzy otrzymali aducanumab, w porównaniu z 10% uczestników, którzy otrzymali placebo.
Chociaż większość osób z obrzękiem obszarów mózgu nie ma objawów, około 30% osób może mieć łagodne objawy, takie jak:
- zamieszanie
- bóle głowy
- zawroty głowy
- zmiany w widzeniu
- nudności
Daniel Gibbs, emerytowany neurolog i wieloletni uczestnik badań klinicznych Aduhelm , podzielił się swoim doświadczeniem z niezwykle rzadkim działaniem niepożądanym ARIA:
"Po pierwsze, i to jest dogmat, który w dużej mierze jest prawdziwy, powinienem powiedzieć, że [ARIA] są zazwyczaj łagodne. Większość ludzi nie wie, że je ma. ARIAs] są tylko złapane na MRI skanach, gdzie będą małe obszary obrzęku albo małe małe małe obszary odkładania żelaza od krwawienia. Jeśli ludzie mają symptomy od nich, oni są zwykle łagodni. Ból głowy jest najczęstszy jeden, czasami dezorientacja.
Jednak prawie zawsze, nawet w przypadku objawowej ARIA, po odstawieniu leku objawy ustępują w ciągu kilku miesięcy. Lek można ponownie bezpiecznie włączyć. Było bardzo niewiele przypadków, przynajmniej takich, które zostały omówione przez producenta leku Biogen, [katastrofalnych lub poważnych ARIA, a mój należał do tej kategorii. [...]
Zaczęłam mieć coraz częstsze bóle głowy. Bóle głowy zdarzają mi się nierzadko, więc tak naprawdę nic o tym nie myślałem, ale stały się one nieco częstsze i być może nieco bardziej dotkliwe, ale nadal łagodzone przez dostępne bez recepty [leki]. [...]
Następnie noc lub dwie przed Bożym Narodzeniem 2017 roku, miałem najgorszy ból głowy w moim życiu, rodzaj, który my jako neurolodzy skojarzylibyśmy z krwotokiem podpajęczynówkowym, masywnym krwawieniem do mózgu. Wziąłem moje ciśnienie krwi i było niebotycznie wysokie i pozostało wysokie, więc myślałem, że mam udar.
Kazałem żonie zabrać mnie na pogotowie, a kiedy dotarłem do naszego lokalnego szpitala, naprawdę nie byłem w stanie przedstawić spójnej historii. [...]
Ale po kilku dniach czułem się już trochę lepiej. Ból głowy ustąpił, ale nadal miałem problemy z czytaniem. Przez następny miesiąc było trochę gorzej. Moje skany rezonansu magnetycznego wykazały, że jest to ARIA z obrzękiem i krwawieniem w całym mózgu. Ponieważ to się nasiliło, uznano, że należy to leczyć. Dostałem pięć dawek sterydów w dużych dawkach i to natychmiast złagodziło ból głowy i dezorientację. Ale musiało upłynąć około sześciu miesięcy, aby obrzęk mózgu całkowicie zniknął."
W związku z tymi rzadkimi, ale poważnymi potencjalnymi działaniami niepożądanymi, lekarze prowadzący leczenie pacjentów będą musieli przeprowadzać badania rezonansu magnetycznego (MRI) przed rozpoczęciem i w trakcie leczenia produktem Aduhelm , aby sprawdzić, czy nie występuje u nich ARIA.
Zatwierdzenie strony Aduhelm (aducanumab)
7 czerwca 2021 roku FDA wydała przyspieszoną zgodę na Aduhelm (aducanumab) w leczeniu choroby Alzheimera.
Przyspieszone zatwierdzenie jest rodzajem zatwierdzenia, które może być przyznane lekom wykazującym pozytywny efekt terapeutyczny w badaniach klinicznych, zanim zostaną przedstawione wszystkie rozstrzygające dowody. Może to mieć zastosowanie wyłącznie do leków stosowanych w poważnych schorzeniach, które zaspokajają niezaspokojone potrzeby medyczne; ostatni lek zatwierdzony w leczeniu choroby Alzheimera został zatwierdzony ponad 18 lat temu.
Przyspieszone zatwierdzenie jest przyznawane warunkowo. FDA wymaga od producenta, firmy Biogen, przeprowadzenia nowego badania klinicznego. w celu zweryfikowania korzyści klinicznych leku Jeśli badanie nie wykaże korzyści, FDA może wycofać zgodę na dopuszczenie leku do obrotu. Biogen ma czas do 2029 roku, aby zakończyć kolejne badanie kliniczne w celu potwierdzenia korzyści aducanumabu dla pacjentów z chorobą Alzheimera; eksperci twierdzą, że trzecie badanie kliniczne, które można zakończyć w ciągu dwóch lat, byłoby lepszą opcją niż czekanie osiem lat, aby dowiedzieć się, czy lek działa, podczas gdy pacjenci przechodzą kosztowne leczenie i mają nadzieję na najlepsze.
Kontrowersje medyczne z podtekstem finansowym
Decyzja FDA o zatwierdzeniu aducanumabu zastanowiła ekspertów, którzy twierdzą, że nie ma wystarczających dowodów na to, że Aduhelm jest skutecznym leczeniem choroby Alzheimera. Wielu z nich, w tym niezależny panel, doradziło F DA, że dostępne dowody budzą poważne wątpliwości, że aducanumab może spowolnić spadek funkcji poznawczych i debatowali nad tym, czy pozytywne wyniki tylko jednego z dwóch badań fazy 3 są wystarczającą podstawą do zatwierdzenia przez FDA.
Wkrótce po zatwierdzeniu, trzech naukowców zrezygnowało w proteście z niezależnego komitetu, który doradzał FDA w sprawie leczenia, powołując się na brak przekonujących dowodów. Skrytykowali oni również decyzję FDA o zatwierdzeniu aducanumabu dla każdego z chorobą Alzheimera, mimo że badanie przeprowadzono na wczesnym stadium Alzheimera, oraz akceptację teorii, że redukcja blaszki amyloidowej faktycznie spowolniłaby objawy poznawcze (mimo rozbieżności w środowisku naukowym co do jej słuszności).
Decyzja FDA o zatwierdzeniu aducanumabu w tych warunkach może mieć kilka konsekwencji.
- Inne leki, które celują w blaszki amyloidowe, takie jak donanemab firmy Eli Lilly, mogą zostać zatwierdzone szybciej niż wcześniej przewidywano, pobudzając zainteresowanie firm farmaceutycznych do inwestowania w leki na Alzheimera lub kontynuowania zaangażowania w istniejące próby.
- Decyzja FDA stworzyła postrzeganie elastyczności regulacyjnej, która mogłaby zachęcić inne firmy biotechnologiczne do opracowania leków na rzadkie schorzenia, napęd, który został rozładowany po długim ciągu niepowodzeń w badaniach klinicznych, szczególnie w ciągu 18 lat pomiędzy zatwierdzeniami terapii Alzheimera.
- Lek jest dość kosztowny - 56 000 dolarów rocznie, co oznacza, że stawki prywatnego ubezpieczenia zdrowotnego mogą wzrosnąć, ponieważ ubezpieczyciele będą musieli za niego zapłacić, a także zwiększy on obciążenie podatników w ramach Medicare (narodowego ubezpieczenia zdrowotnego w USA). Niektórzy twierdzą, że może to być "druzgocące" dla Medicare, nie tylko ze względu na koszty bazowe, ale także dlatego, że leczenie za pomocą Aduhelm wymaga od pacjentów wcześniejszych diagnoz z kranikami rdzeniowymi w celu wykrycia amyloidu i stałego monitorowania za pomocą MRI (między innymi), co znacznie zwiększa koszty i wywiera presję na systemy medyczne.
Zatwierdzenie leku jest również postrzegane jako zysk dla firmy Biogen, ponieważ jej akcje wzrosły o ponad 50%, podczas gdy akcje japońskiego partnera, firmy Eisai Co, wspięły się o 56%. Aduhelm może potencjalnie przynieść około 10 miliardów dolarów sprzedaży, przewidują analitycy, biorąc pod uwagę, że w samych Stanach Zjednoczonych jest 6 milionów osób, u których zdiagnozowano chorobę Alzheimera. Lek ten jest ważny dla wzrostu firmy Biogen, ponieważ konkurencja zaszkodziła sprzedaży ich leków - Tecfidera na stwardnienie rozsiane (MS) oraz Spinraza na rdzeniowy zanik mięśni (SMA).
Spinraza jest kolejnym lekiem w portfolio firmy Biogen o wysokiej cenie, wynoszącej 750 000 dolarów za pierwszy rok leczenia i 375 000 dolarów za każdy kolejny rok.
Nie wszyscy są krytyczni wobec decyzji FDA o zatwierdzeniu Aduhelm
Ponieważ choroba Alzheimera jest chorobą postępującą, pacjenci potrzebują leczenia raczej wcześniej niż później. Wiadomość o decyzji FDA dała wielu osobom nową nadzieję, że leczenie będzie skuteczne dla nich samych lub ich bliskich, lub że pobudzi inne firmy do działania w celu opracowania innych metod leczenia choroby Alzheimera.
Grupy wspierające pacjentów energicznie naciskały na zatwierdzenie leku, ponieważ istnieje tylko sześć innych metod leczenia tej wyniszczającej choroby, które łagodzą objawy tylko na kilka miesięcy. W listopadzie 2020 r. komitet doradczy FDA zagłosował przeciwko zatwierdzeniu Aduhelm, co wywołało gniew, a następnie działania Stowarzyszenia Alzheimera, które następnie przeprowadziło kampanię, aby wyrazić swoje poparcie dla potencjału leku i podkreślić potrzebę nadziei i postępu.
W styczniu 2021 r. FDA i grupy pacjentów spotkały się na sesji wysłuchania, podczas której pacjenci, opiekunowie, klinicyści i adwokaci opowiedzieli się za leczeniem, argumentując między innymi, że pacjenci nie mogą sobie pozwolić na dłuższe oczekiwanie na leczenie.
Dyrektor FDA Office of New Drugs Peter Stein potwierdził podczas konferencji prasowej, że opinie pacjentów odegrały rolę. Powiedział, że FDA "bardzo wyraźnie słyszała od pacjentów, że są gotowi zaakceptować pewną niepewność, aby mieć dostęp do leku, który może zapewnić znaczące korzyści w zapobieganiu postępowi tej choroby, która, jak wszyscy wiemy, może mieć bardzo niszczące konsekwencje."
Patrizia Cavazzoni, p.o. dyrektora FDA's Center for Drug Evaluation and Research, powiedział podczas tej samej konferencji prasowej, że "dane wspierają pacjentów i opiekunów mających wybór do korzystania z tego leku."
"To zatwierdzenie leku przez FDA wprowadza nową erę w leczeniu i badaniach nad chorobą Alzheimera", powiedziała Maria Carrillo, Ph.D, dyrektor naukowy Alzheimer's Association. "Historia pokazała nam, że zatwierdzenia pierwszego leku w nowej kategorii ożywia pole zwiększa inwestycje w nowe metody leczenia i zachęca do większej innowacyjności."
Kiedy Aduhelm zostanie zatwierdzony w Europie?
Choroba Alzheimera szybko zyskuje miano jednego z największych kryzysów medycznych, gospodarczych i społecznych stulecia - i to takiego, który trudno jest wykryć na wczesnym etapie, zwłaszcza biorąc pod uwagę brak specjalistów w Europie, którzy mogliby potwierdzić diagnozę. W samej Europie w 2018 r. na chorobę Alzheimera i inne formy demencji cierpi 9,7 mln osób; przewiduje się, że do 2030 r. liczba chorych wzrośnie do 14 mln, co stworzy ogromne zapotrzebowanie na skuteczne leczenie.
Aduhelm nie został jeszcze zatwierdzony poza Stanami Zjednoczonymi. Firma Biogen złożyła wniosek o przeprowadzenie przeglądu regulacyjnego w Unii Europejskiej w październiku 2020 r., a także w Japonii, Kanadzie, Australii i Brazylii pod koniec roku 2020.
Według Europejskiej Agencji Leków (EMA) ocena wniosku o dopuszczenie do obrotu nowego leku trwa zazwyczaj około roku, krócej, jeśli twórca leku uzyskał przyspieszoną ocenę.
W marcu tego roku, wart 2 miliardy dolarów zakład produkcyjny firmy Biogen w Szwajcarii otrzymał licencję Dobrej Praktyki Wytwarzania (GMP) od Szwajcarskiej Agencji Produktów Terapeutycznych (Swissmedic). Biogen planuje wystąpić do FDA o zgodę na produkcję Aduhelm w szwajcarskim zak ładzie pod koniec 2021 r. i spodziewa się dostarczać lek ponad 1 milionowi pacjentów rocznie.
Dostęp do witryny Aduhelm poza Stanami Zjednoczonymi
Aduhelm jest obecnie zatwierdzony przez FDA i dostępny dla mieszkańców Stanów Zjednoczonych - a istnieją przepisy, które pozwalają na import leków w krajach, w których nie są one obecnie zatwierdzone.
Pacjenci cierpiący na choroby zagrażające życiu lub powodujące przewlekłą niepełnosprawność mają prawo do dostępu, zakupu i importu leków z pomocą swoich lekarzy prowadzących.
Pacjenci i ich lekarze mogą to robić na zasadzie compassionate use lub na podstawie przepisów dotyczących przywozu nazwanych pacjentów, co stanowi prawny wyjątek od ogólnej zasady, że lek może być dostępny wyłącznie po uzyskaniu zezwolenia/zatwierdzenia rynkowego (niezależnie od użytego sformułowania) w kraju, w którym mieszka pacjent. Wyjątek ten pozwala pacjentom w legalny, etyczny i bezpieczny sposób uzyskać dostęp do leków, które nie zostały jeszcze zatwierdzone w ich kraju.
Więcej na temat "podstawy nazwanego pacjenta" można przeczytać tutaj (EMA).
everyone.org dokładamy wszelkich starań, aby pacjenci i ich lekarze mieli dostęp do wszelkich leków dostępnych na całym świecie w celu jak najlepszego leczenia. Działamy w 100% zgodnie z przepisami obowiązującymi w Twoim kraju, jeśli przebywasz poza Stanami Zjednoczonymi. Jeśli chcesz przeczytać więcej szczegółów, uzyskać dostęp do leku lub skontaktować się z naszym zespołem wsparcia, możesz to zrobić tutaj.
Ile kosztuje Aduhelm ?
Firma Biogen ogłosiła, że koszt Aduhelm przy dawce podtrzymującej (10 mg/kg) dla przeciętnego pacjenta wyniósłby 56 000 dolarów rocznie. Nie obejmuje to badań, które pacjenci muszą wykonać przed leczeniem i w trakcie leczenia.
Biogen spotkał się z krytyką dotyczącą wysokiej ceny leku na rok.
Instytut Analiz Klinicznych i Ekonomicznych (ICER), który analizuje ceny leków, wskazał, że uczciwa roczna cena wahałaby się od 2 500 do 8 300 dolarów na pacjenta każdego roku. W swoim oświadczeniu ICER powiedział, że zatwierdzenie przez FDA nie ochroniło pacjentów, a Biogen może zebrać ponad 50 miliardów dolarów rocznie "nawet czekając na dowody potwierdzające, że pacjenci otrzymują rzeczywiste korzyści z leczenia."
Dyrektor generalny firmy Biogen, Michel Vounatsos, odpowiedział na krytykę zapewniając, że cena leku jest uzasadniona wartością, jaką przyniesie on pacjentom i społeczeństwu mniej obciążonemu chorobą Alzheimera, oraz że cena jest odzwierciedleniem "dwóch dekad braku innowacji". "Nadszedł czas, aby zainwestować w leczenie" - dodał.
Na stronie everyone.org nie mamy wpływu na cenę ustaloną przez firmę Biogen. Jesteśmy w stanie pomóc pacjentom uzyskać dostęp do strony Aduhelm w następujących cenach:
- 1 958,58 € za jedną fiolkę 170 mg/1,7 mL (100 mg/mL)
- 3 046,68 € za jedną fiolkę 300 mg/3 mL (100 mg/mL)
Tutaj można złożyć zapytanie w celu uzyskania dalszych informacji.
Przygotowywane metody leczenia choroby Alzheimera
Z badania opublikowanego w maju 2021 r. wynika, że obecnie w badaniach klinicznychnad chorobą Alzheimera znajduje się 126 metod leczenia. 82,5% z nich ukierunkowanych jest na modyfikację choroby, 10,3% poprawia zdolności poznawcze, a 7,1% skupia się na łagodzeniu objawów neuropsychiatrycznych.
- Badania fazy 3: 28 metod leczenia (w tym aducanumab)
- Badania fazy 2: 74 leczenia
- Badania fazy 1: 24 zabiegi
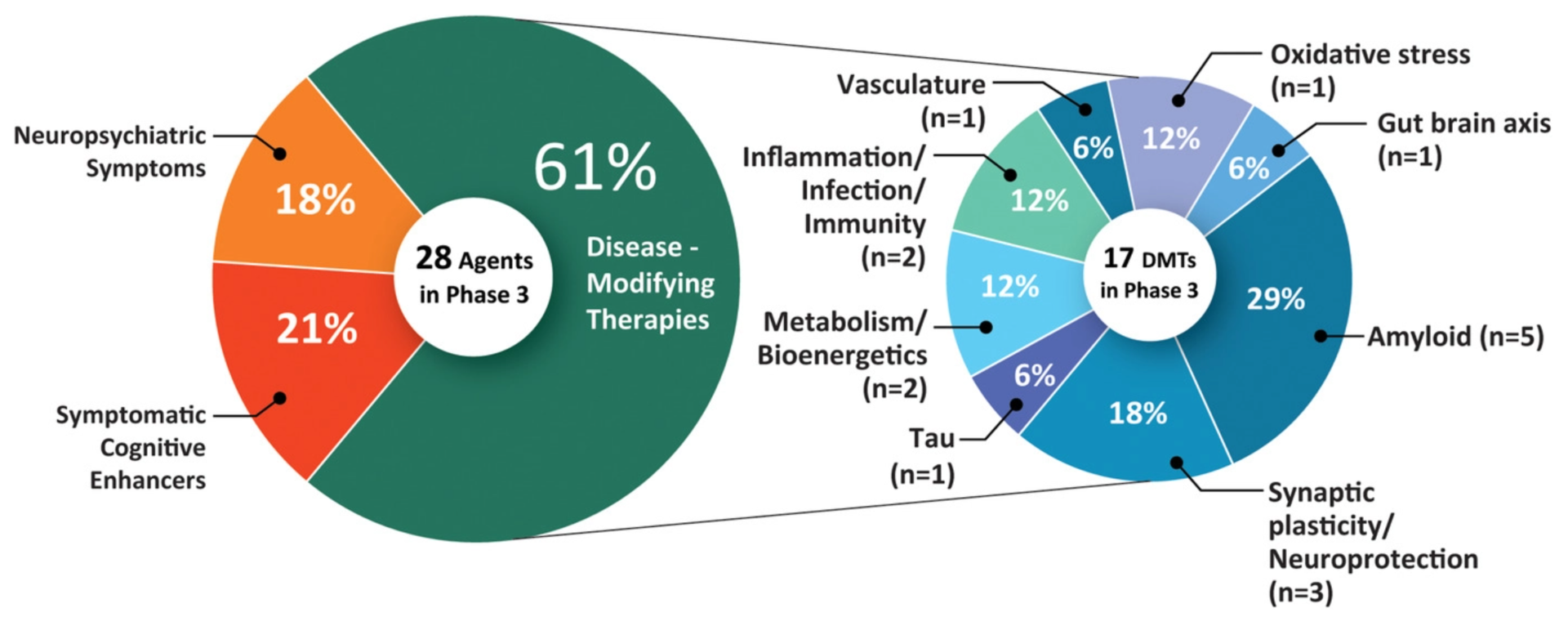
Terapie w fazie 3 badań najprawdopodobniej zostaną zatwierdzone w nadchodzącym roku.
Lecanemab
Działając w podobny sposób jak aducanumab (wyzwalając układ odpornościowy do usuwania blaszek beta-amyloidu), przeciwciało monoklonalne lecanemab wykazuje obiecujące działanie, zgodnie z opublikowanymi raportami, i przeszło do fazy 3 badań klinicznych.
Gantenerumab
Gantenerumab wiąże się z beta-amyloidem, szczególnie z blaszkami beta-amyloidu w porównaniu z pojedynczymi beta-amyloidami krążącymi we krwi. Uważa się, że rozpuszcza on blaszki amyloidowe i usuwa beta-amyloid poprzez stymulację fagocytozy, czyli procesu, w którym komórka przyjmuje pewną cząsteczkę do swojego wnętrza i trawi ją. Poprzednie badania kliniczne nad gantenerumabem wykazały, że zmniejszył on ilość blaszek beta-amyloidowych u osób z bardziej powszechną postacią choroby Alzheimera, która nie jest bezpośrednio spowodowana mutacjami genów. Jest on nadal badany w dwóch dużych globalnych badaniach III fazy.
Solanezumab
Solanezumab jest przeciwciałem, które ma na celu "oczyszczenie" beta-amyloidu z krwi i płynu mózgowo-rdzeniowego, zapobiegając w ten sposób tworzeniu się blaszek miażdżycowych. Korzyści odnotowano u uczestników, którzy brali udział w pełnym, trzyipółletnim okresie badań, a w mniejszym stopniu u tych, którzy dołączyli później, więc wciąż można się więcej dowiedzieć o jego działaniu.
Donanemab
Donanemab wydaje się być kolejnym obiecującym, nadchodzącym lekiem w leczeniu choroby Alzheimera. Jest on testowany przez firmę Eli Lilly and Company, która planuje włączyć 1500 uczestników do dużego badania, aby potwierdzić wyniki mniejszego badania; poprzednie badanie trwało 76 tygodni i objęło 257 pacjentów i według doniesień wykazało, że donanemab znacząco spowolnił postęp choroby Alzheimera.
Inni
Saracatinib jest eksperymentalnym związkiem, który działa jako inhibitor białka zwanego kinazą Fyn, która wspomaga tworzenie się blaszek beta-amyloidowych. Badanie przeprowadzone na myszach wykazało, że sarakatynib, poprzez hamowanie kinazy Fyn, był skuteczny w odwracaniu utraty pamięci u myszy. Hamowanie kinazy Fyn może zapobiegać lub opóźniać postęp choroby.
Naukowcy z Salk Institute for Biological Studies w Kalifornii badają substancję chemiczną o nazwie fisetyna i opracowali wersję fisetyny o nazwie CMS121, która okazała się skuteczna w spowalnianiu utraty komórek mózgowych. Więcej badań jest wymagane, zanim lek będzie gotowy do zatwierdzenia.
W odniesieniu do Aduhelm's niedawnej aprobaty, Maria Carrillo, Chief Science Officer dla pacjenta-adwokackiej grupy Alzheimer's Association w Chicago, USA, powiedział w oświadczeniu dla Nature: "Jesteśmy pełni nadziei, a to jest początek - zarówno dla tego leku, jak i dla lepszych metod leczenia choroby Alzheimera".
"Wszystko, czym naprawdę jesteśmy, to nasze myśli i nasz mózg." - Sandy, była dentystka i asystentka profesora oraz pacjentka z chorobą Alzheimera.
Na stronie everyone.org jesteśmy przekonani, że nauka posuwa ludzkość naprzód i poprawia, a nawet ratuje życie. Choroba Alzheimera zagraża jakości życia wielu osób. Zachęcamy naukowców zaangażowanych w znalezienie (części) rozwiązania do wytrwałości i czekamy na zatwierdzenie opracowywanych terapii wykazujących obiecujące wyniki i udostępnienie ich pacjentom z chorobą Alzheimera na całym świecie w ciągu najbliższych 3 lat.




