Jaka jest różnica między Leqembi a Aduhelm? Prosty przegląd.
Ostatnia aktualizacja: 19 listopada 2024 r.
Możesz legalnie uzyskać dostęp do nowych leków, nawet jeśli nie zostały one zatwierdzone w Twoim kraju.
Dowiedz się jakOd 2021 r. FDA przyznała przyspieszone zatwierdzenie dwóm nowym lekom na chorobę Alzheimera. Leki te to terapie antyamyloidowe Leqembi ( lecanemab) i Aduhelm (aducanumab). Oba zatwierdzenia nastąpiły po prawie 20 latach bez większych przełomów w leczeniu choroby Alzheimera. Z tego powodu oba leki spotkały się z dużym zainteresowaniem mediów.
Odbiór był jednak mieszany. Maria Carrillo, dyrektor naukowy Stowarzyszenia Alzheimera, określiła zatwierdzenie nowych leków jako "kamień milowy dla osób kwalifikujących się do tego leczenia" [2]. Jednocześnie proces ich zatwierdzania był otoczony kontrowersjami, zwłaszcza w przypadku Aduhelm [1, 4].
Jako pacjent prawdopodobnie zastanawiasz się, jaka jest różnica między Leqembi (lecanemab) i Aduhelm (aducanumab). W tym artykule porównamy te dwa leki pod względem sposobu ich działania, skuteczności, a także kosztów i dostępności.
Leqembi vs Aduhelm: Do czego służą?
Oba leki są stosowane w leczeniu wczesnej choroby Alzheimera. Są to terapie antyamyloidowe, których celem są blaszki amyloidowe w mózgu.
Zgodnie z informacjami dotyczącymi przepisywania leków, Leqembi i Aduhelm są przeznaczone dla pacjentów z łagodnymi zaburzeniami poznawczymi i z potwierdzonym podwyższonym poziomem beta-amyloidu [5].
Leqembi vs Aduhelm: Jak działają?
Podobieństwa
Leqembi (lecanemab) i Aduhelm (aducanumab) są przeciwciałami monoklonalnymi. Zostały one zaprojektowane w celu zwalczania blaszek beta-amyloidowych, które gromadzą się w mózgach pacjentów z chorobą Alzheimera. Uważa się, że blaszki te przyczyniają się do pogorszenia funkcji poznawczych i pogorszenia stanu klinicznego obserwowanego w tej chorobie.
Oba leki wiążą się i neutralizują blaszki amyloidowe w celu spowolnienia postępu choroby. To właśnie sprawia, że Leqembi i Aduhelm zasadniczo różnią się od poprzednich terapii choroby Alzheimera, takich jak galantamina, rywastygmina i donepezil. Te poprzednie terapie koncentrują się na łagodzeniu objawów choroby. Leqembi i Aduhelm dążą do zmiany przebiegu choroby, celując w jej pierwotną przyczynę.
Różnice
Leqembi i Aduhelm wiążą się z różnymi częściami białka beta-amyloidu. Aduhelm silniej wiąże się z większymi, stwardniałymi blaszkami amyloidowymi. Leqembi jest lepiej ukierunkowany na mniejszą, rozpuszczalną (i bardziej toksyczną) formę białka amyloidowego [6].
Jak skuteczni są Leqembi i Aduhelm?
Skuteczność leków Leqembi (lekanemab) i Aduhelm(adukanumab) badano w badaniach klinicznych.
-
Wyniki badań klinicznych Leqembi
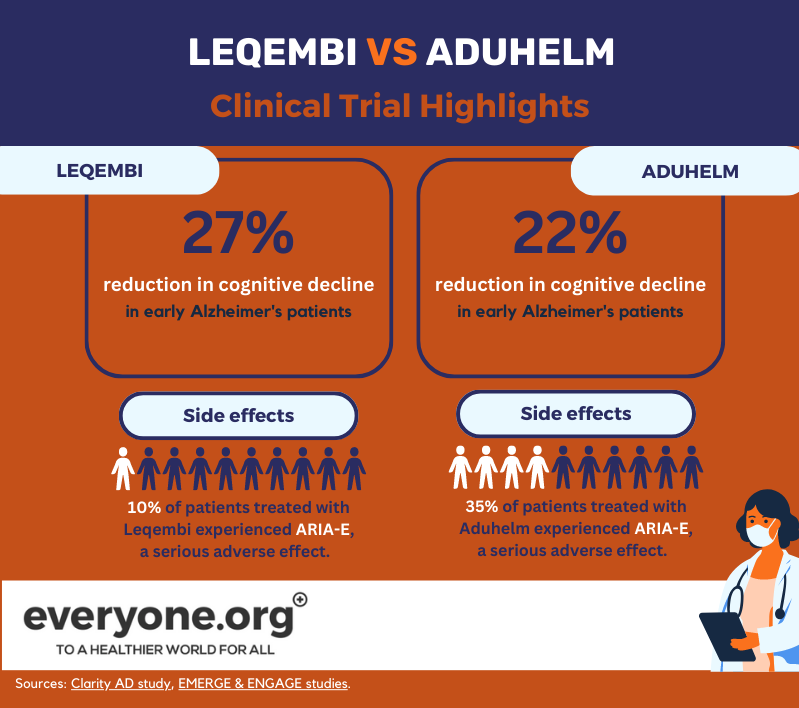
Przyspieszone zatwierdzenie Leqembi przez FDA opierało się na pozytywnych wynikach badania fazy 3 Clarity AD. Zgodnie z tymi wynikami, Lecanemab spowolnił spadek funkcji poznawczych nawet o 27% u pacjentów z wczesną postacią choroby Alzheimera, w porównaniu z placebo. Wyniki te mierzono po 18 miesiącach od rozpoczęcia leczenia [8].
Dodatkowa analiza wyników badania została opublikowana w kwietniu 2023 roku. Wykazała ona, że nawet po tym, jak pacjenci przestali przyjmować Leqembi przez okres od 9 do 59 miesięcy, nadal odnosili korzyści z opóźnienia pogorszenia funkcji poznawczych. W tym "okresie przerwy" choroba Alzheimera wydawała się postępować konsekwentnie wolniej u pacjentów, którzy otrzymywali Leqembi w pierwotnym badaniu klinicznym, w porównaniu z pacjentami otrzymującymi placebo [7].
Poważne działanie niepożądane ARIA-E wystąpiło u 10% pacjentów leczonych Leqembi. U 6% pacjentów w badaniu wystąpiło ARIA-H, kolejne poważne działanie niepożądane [13].
-
Wyniki badań klinicznych Aduhelm
FDA przyznała Aduhelm przyspieszoną zgodę na podstawie dwóch badań klinicznych fazy 3. Jedno z nich (EMERGE) wykazało zmniejszenie pogorszenia stanu klinicznego pacjentów nawet o 22% [12]. Drugie badanie (ENGAGE) tego nie wykazało. W obu badaniach Aduhelm wykazał jednak redukcję blaszek amyloidowych w mózgu [9]. FDA zdecydowała, że to wskazanie "z uzasadnionym prawdopodobieństwem przyniesie [korzyści] kliniczne" [10].
Badanie potwierdzające fazy 4 (ENVISION) rozpoczęło się w czerwcu 2022 r., zgodnie z wnioskiem FDA. Wyniki spodziewane są w 2026 roku [9].
Zgodnie z informacją o przepisywaniu leku Aduhelm, 35% pacjentów otrzymujących lek w badaniach klinicznych doświadczyło ARIA-E. U 34% pacjentów biorących udział w badaniu wystąpiła ARIA-H [15].
Jak pokazują obecne dane, główna różnica między Leqembi i Aduhelm w tym momencie wydaje się dotyczyć ich profilu bezpieczeństwa, przy czym Leqembi wykazuje mniejszą częstość występowania działań niepożądanych.
Jednocześnie, w oparciu o aktualne dane z badań klinicznych, Leqembi wydaje się zapewniać bardziej spójny wpływ na pogorszenie funkcji poznawczych. Wyniki trwających badań nad Leqembi i Aduhelm zapewnią większą jasność co do skuteczności obu leków.
UWAGA: Udostępnione tutaj wyniki służą celom informacyjnym i nie powinny być wykorzystywane jako podstawa wyboru leczenia. Lekarz jest w stanie najlepiej określić leczenie, które najlepiej pasuje do danego przypadku.

Leqembi vs Aduhelm: Bezpieczeństwo i skutki uboczne
Zgodnie z informacjami dotyczącymi przepisywania leków, są to najczęstsze działania niepożądane Leqembi (lecanemab) i Aduhelm:
Leqembi skutki uboczne
- reakcje związane z infuzją, w tym gorączka, objawy grypopodobne, nudności, zmiany częstości akcji serca i duszność;
- ból głowy;
- Nieprawidłowości w obrazowaniu związane z amyloidem (ARIA) [13]. ARIA może obejmować tymczasowy obrzęk lub krwawienie w mózgu. Objawami ARIA są bóle głowy, dezorientacja, drgawki, trudności z chodzeniem i zawroty głowy. Nosiciele homozygotycznego genu apolipoproteiny E mogą być bardziej narażeni na ARIA [14].
Aduhelm skutki uboczne
Najczęstsze działania niepożądane leku Aduhelm to ARIA, bóle głowy i upadki. Jednym z działań niepożądanych określonych dla leku Aduhelm , ale nie dla leku Leqembi, jest nadwrażliwość. Reakcje nadwrażliwości mogą obejmować obrzęk naczynioruchowy (obrzęk głębszych warstw skóry) i pokrzywkę (wysypka skórna) [15].
Leqembi vs Aduhelm: Porównanie cen
Jeśli chodzi o leki, które nie są jeszcze powszechnie dostępne, należy traktować każdą cenę jedynie jako wskazówkę. Ostateczne koszty mogą się różnić w zależności od lokalizacji, dostawców lub zakresu ubezpieczenia.
Aby dać ci wyobrażenie, pojedyncza fiolka Leqembi kosztuje około 1 043 EUR. Przy zalecanym podawaniu leku co dwa tygodnie, roczny koszt dla 1 osoby wynosi około 27 118 EUR [16].
Orientacyjna cena leku Aduhelm za fiolkę jednodawkową wynosi 1 335 EUR. W przeliczeniu na roczne koszty dla 1 osoby daje to kwotę 34 710 EUR [17].
Gdzie zatwierdzono Leqembi i Aduhelm ?
Leqembi (lecanemab) jest obecnie zatwierdzony tylko w USA i Wielkiej Brytanii, a jego zatwierdzenie przez EMA spodziewane jest do końca 2024 r.[3]. Leqembi złożył również wnioski o pozwolenie na dopuszczenie do obrotu w Chinach i Japonii [18, 19, 20].
Aduhelm (aducanumab) uzyskał przyspieszone zatwierdzenie przez FDA w USA w czerwcu 2021 roku. Europejska Agencja Leków (EMA) odrzuciła wniosek o dopuszczenie Aduhelm do obrotu w grudniu 2021 roku. Wniosek został następnie wycofany przez Biogen w kwietniu 2022 r . [21]. Japońskie Ministerstwo Zdrowia również wysłało negatywny sygnał dotyczący zatwierdzenia Aduhelm w tym kraju [22].
Czy Leqembi lub Aduhelm nie są (jeszcze) zatwierdzone lub dostępne w Twoim kraju? Jeśli ty i twój lekarz uważacie, że te terapie mogą być dla ciebie korzystne, skontaktuj się z naszym zespołem ekspertów ds. dostępu medycznego. Możemy przedstawić spersonalizowaną ofertę cenową na pozyskanie leku dla Ciebie.
Referencje:
- Przeciwciało monoklonalne anty-amyloidowe Lecanemab: 16 uwag ostrzegawczych. Zenodo, 3 stycznia 2023 r.
- Hamilton, Jon. FDA przyznaje Leqembi przyspieszone zatwierdzenie leku na chorobę Alzheimera: Shots - Health News. NPR, 6 stycznia 2023 r.
- Komitet Doradczy FDA jednogłośnie głosuje za potwierdzeniem korzyści klinicznych LEQEMBI® (lecanemab-irmb) w leczeniu choroby Alzheimera. Biogen | Relacje inwestorskie, 9 czerwca 2023 r.
- Helmore, Edward. FDA pod ostrzałem w związku z zatwierdzeniem leku Aduhelm na chorobę Alzheimera. The Guardian, 29 grudnia 2022 r.
- NAJWAŻNIEJSZE INFORMACJE O PRZEPISYWANIU LEKU. Leqembi, dostęp 3 sierpnia 2023 r.
- Taylor, Emma. Nowe leczenie choroby Alzheimera, lecanemab, trafia na pierwsze strony gazet: co dalej? Alzheimer's Research UK, 13 grudnia 2022 r.
- Eisai: Pacjenci z chorobą Alzheimera widzą korzyści z Leqembi nawet po jego zatrzymaniu. CNBC, 6 kwietnia 2023 r.
- Leqembi | ALZFORUM. Alzforum, 30 maja 2023, dostęp 3 sierpnia 2023.
- Aduhelm | ALZFORUM. Alzforum, 6 lutego 2023, dostęp 3 sierpnia 2023.
- Cavazzoni, Patrizia. Decyzja FDA o zatwierdzeniu nowego leczenia choroby Alzheimera. FDA, 7 czerwca 2021 r.
- Eisai przedstawia pełne wyniki badania III fazy lekanemabu Clarity AD. Alzheimer Europe, 30 listopada 2022 r.
- Najważniejsze wyniki badań EMERGE i ENGAGE: Dwa badania fazy 3 oceniające Aducanumab u pacjentów z wczesną chorobą Alzheimera. Biogen | Relacje inwestorskie, dostęp 3 sierpnia 2023 r.
- Identyfikator referencyjny: 5105416. Accessdata.fda.gov, Dostęp 3 sierpnia 2023 r.
- PRZEWODNIK PO MEDYCYNIE LEQEMBI® (leh-kem'-bee) (lecanemab-irmb) wstrzyknięcie, do podawania dożylnego. Leqembi, dostęp 3 sierpnia 2023 r.
- NAJWAŻNIEJSZE INFORMACJE DOTYCZĄCE PRZEPISYWANIA. Accessdata.fda.gov, dostęp 3 sierpnia 2023 r.
- Kup Leqembi (lecanemab-irmb) Online - Cena i koszty. Everyone.org, Dostęp 3 sierpnia 2023 r.
- Kup Aduhelm (aducanumab-avwa) Online - Cena i koszty. Everyone.org, Dostęp 3 sierpnia 2023 r.
- EISAI SKŁADA WNIOSEK O ZEZWOLENIE NA DOPUSZCZENIE DO OBROTU LEKU LECANEMAB JAKO TERAPII WCZESNEJ CHOROBY ALZHEIMERA W EUROPIE | Biogen. Biogen | Relacje inwestorskie, 10 stycznia 2023 r.
- Eisai rozpoczyna składanie danych BLA dla leku Lecanemab w Chinach | Biogen. Biogen | Relacje inwestorskie, 22 grudnia 2022 r.
- Carvalho, Teresa, i Ray Burow. Lecanemab na wczesną postać choroby Alzheimera zostanie poddany przeglądowi w Japonii. Alzheimer's News Today, 14 marca 2022 r.
- Aktualizacja dotycząca wniosku regulacyjnego dla Aducanumabu w Unii Europejskiej | Biogen. Biogen | Relacje inwestorskie, 22 kwietnia 2022 r.
- Swift, Rocky, et al. Lek Eisai-Biogen na chorobę Alzheimera trudny do oceny - japońskie ministerstwo. Reuters, 22 grudnia 2021 r.